最近发现了一种与特发性/孤立性快速眼动睡眠行为障碍(iRBDconvRP)患者表型转化相关的脑葡萄糖代谢模式。然而,需要在外部独立的iRBD患者组中验证iRBDconvRP,以验证该模式的可重复性,从而增加其在临床和研究环境中的重要性。这项工作的目的是在一组独立的iRBD患者中验证iRBDconvRP。
首尔大学40例iRBD患者(70±5.59岁,女性19例)行脑[18F]FDG-PET检查。13例患者在随访中出现表型转变(帕金森病7例,路易体痴呆5例,多系统萎缩1例;随访时间(35±20.56个月),27例患者在距基线62±29.49个月后仍无帕金森病/痴呆。我们应用先前鉴定的iRBDconvRP来验证其表型转化预测能力。
iRBDconvRP显著区分转化者和非转化者iRBD患者(p=0.016;曲线下面积0.74,敏感性0.69,特异性0.78),显著预测表型转化(风险比4.26,ci - 95%: 1.18-15.39)。
iRBDconvRP在一组独立的iRBD患者中证实了其预测表型转化的稳健性,表明其作为疾病改善试验的分层生物标志物的潜在作用。
快速眼动睡眠行为障碍(Rapid eye movement sleep behavior disorder, RBD)是一种睡眠异常症,主要表现为在快速眼动睡眠期间由于生理性肌肉张力丧失而导致的梦境行为[1]。
当RBD没有明显的神经系统症状时,通常被定义为“特发性/孤立性”(iRBD)。尽管如此,至少70%的iRBD患者在随访期间最终会发展为帕金森病和/或痴呆[2-5]。然而,表型转化时间是高度可变的,患者在诊断后10年未发生表型转化[6,7]。突触核蛋白病有一个很长的前驱期,RBD的存在是迄今为止早期神经退行性疾病最强的生物标志物。因此,iRBD患者是未来疾病修饰治疗的良好候选者。然而,能够预测iRBD患者短期表型转化的有效生物标志物尚未确定。[18F]氟脱氧葡萄糖正电子发射断层扫描([18F]FDG-PET)是一种很有前途的短期表型转化生物标志物。事实上[18F], FDG-PET已经能够描述几种神经系统疾病的疾病特异性脑代谢模式,包括iRBD[8]和帕金森病(PD)[8,9],这要归功于缩放子轮廓建模和主成分分析(SSM-PCA)[10]。这种方法可以提取体素之间的协方差模式。
在iRBD患者中,pd相关模式(PDRP)的表达随着时间的推移而增加[10],而iRBD相关模式(RBDRP)的表达随着时间的推移而减少[11],这表明iRBD患者正在改变其脑糖代谢模式,更接近表型转化。事实上,RBDRP在不同的患者队列中被发现[9,11,12],表现出相似但不完全重叠的模式。这些数据证实,iRBD患者的脑葡萄糖代谢具有高度异质性[13],这可能是由于不同的结果表型转化诊断(即帕金森先与痴呆先)和表型转化时间(即早期转化者与晚期/非转化者)。作为iRBD患者脑糖代谢异质性的进一步证实,PDRP是表型转化的良好预测因子,但在新发PD合并RBD患者中获得的模式(dnPDRBD-RP)甚至更好[14]。然而,必须强调的是,iRBD患者可能会发展为PD,路易体痴呆(DLB),以及不太常见的多系统萎缩(MSA)。因此,疾病特异性相关模式,如PDRP,甚至dnPDRBD-RP,可能不是涵盖所有可能结果的最佳选择。
最近,一种与iRBD表型转化相关的脑糖代谢模式(iRBDconvRP)已被证明是稳健可靠的,可用于区分iRBD转化者和非转化患者,并且无论表型转化诊断如何,都具有良好的预测能力[15]。然而,为了证实其临床和研究的有效性,确定的iRBDconvRP必须在一组独立的患者中进行验证。
因此,本研究的目的是通过将先前描述的iRBDconvRP应用于从不同部位招募的iRBD患者的单独队列来验证其表型转化预测能力。
2013 - 2015年间,从韩国首尔国立大学医学院招募了40例iRBD患者(平均年龄70±5.59岁,男性21例)[16,17]。RBD的诊断采用视频多导睡眠图(video-polysomnography),按照现行标准[18]。排除标准的设置是为了排除RBD的继发原因,如前所述[16,17]。排除标准为精神或神经系统合并症、中度至重度阻塞性睡眠呼吸暂停、除轻度白质高信号外的病理MRI表现,以及存在痴呆和/或帕金森症,符合PD、DLB或MSA的基线诊断标准[17,19 -21]。脑MRI用于排除脑部疾病[17,22]。如果每个脑区Wahlund评分不> 1,则白质高信号的存在不是排除标准[23]。在基线时,所有患者均接受运动障碍学会统一帕金森病评定量表、运动部分(MDS-UPDRS-III)来调查帕金森病的存在、迷你精神状态检查(MMSE)作为整体认知功能的测量,以及综合神经心理学评估(首尔神经心理学筛查组[24])。包括每个主要认知领域的至少两个测试(言语记忆-首尔言语学习测试(SVLT)即时回忆,延迟回忆和识别-执行功能-TMT B和控制口头单词联想测试(COWAT)-注意和工作记忆-线索测试(TMT) A,数字广度和颜色-单词Stroop测试(CWST)-)。视觉空间能力- rey - osterrieth复杂图形测试(RCFT)和波士顿命名测试(K-BNT)的韩文版本[17],以评估轻度认知障碍(MCI)的存在[25]。13例患者在随访中表型转化为明显的α -突触核蛋白病(7例PD, 5例DLB, 1例MSA;随访时间:35±20.56个月;27例患者在平均62±29.49个月(iRBD诊断前病程24.95±36.61个月)后无帕金森病/痴呆。需要注意的是,随访时间是指从[18F]FDG-PET检查日期到转归患者表型转化日期,以及[18F]FDG-PET检查日期到非转归患者最后一次随访日期之间的生存时间,以月为单位。人口学和临床数据见表1。
根据赫尔辛基宣言,所有受试者在参加本研究前都提供了书面知情同意书。
[18F]FDG-PET采用PET/CT (Philips Gemini TF-64 PET/CT扫描仪,Philips Healthcare, Best, The Netherlands)。所有[18F]FDG-PET图像在静态模式下获取,然后使用SPM12 (Wellcome Department of Cognitive Neurology, London, UK)对其进行仿射和非线性空间归一化,进入Montreal Neurological Institute (MNI)的脑空间。采用SPM的所有默认设置,参考特定的[18F]FDG-PET脑模板[26]。
然后使用10毫米各向同性高斯滤波器对空间归一化的图像集进行平滑处理,以考虑个体解剖差异并提高信噪比。中心特定成像方案和分析的细节已在其他地方描述[11,15,17,27]。
患者接受夜间多导睡眠图(PSG)检查。按照现行标准进行睡眠评分[28]。根据推荐规则[28]放置PSG衍生品,以评估睡眠特征、呼吸、心脏和肢体事件。患者被要求在记录前2周停用褪黑激素、催眠药物和抗抑郁药物[16,17]。评估由睡眠医学专家进行。
先前导出并验证的iRBDconvRP[15]应用于[18F]入组的40名iRBD患者的FDG-PET扫描,以提取模式表达的受试者评分(相对于非转换iRBD患者进行z转换),用于进一步分析。这种模式的推导和验证的细节在其他地方有广泛的描述[15]。简而言之,iRBDconvRP是使用荷兰格罗宁根大学医学中心(UCMG)基于Spetsieris和Eidelberg[31]的SSM-PCA方法开发的自动算法[29,30]导出的,该算法在Matlab(版本2020a;MathWorks, Natick, MA, USA)。简而言之,SSM-PCA允许进行空间协方差分析,通过考虑受试者间体素之间的关系,能够识别[18F]FDG-PET数据中的相关模式。模式表达的程度然后由单个受试者得分反映,以便在单个受试者水平上客观地评估疾病活动。因此,SSM-PCA应用于30名转换者和46名非转换者iRBD患者的数据集,这些患者登记在两个不同的意大利中心(热那亚和罗马托维加塔)。首先,我们分别为每个中心导出了两个不同的模式。其次,我们汇总数据以确定总数据集中的iRBDconvRP(热那亚+罗马Tor Vergata iRBD患者:30名转换者和46名非转换者)。模式分析将注意力集中在正或负共变的体素上。我们只能推测,从病理学的角度来看,阳性和阴性成分分别代表较高和较低的代谢。相应的,小脑、脑干、前扣带皮层、颞中中段和中中段及后中央区、慢状核均有iRBDconvRP阳性成分(糖代谢相对较高),而扣带后、楔前叶、额回中、顶叶区有负成分(糖代谢相对较低)。
由于缺乏外部组,我们进行了留一交叉验证(LOOCV)[9,32]来确认模式的稳定性。
摘要
介绍
材料与方法
统计分析
结果
讨论
数据可用性
参考文献
致谢
作者信息
道德声明
搜索
导航
#####
采用Shapiro-Wilk检验检验变量的正态分布。连续变量的比较采用非配对t检验(正态分布)或Wilcoxon-Mann-Whitney检验(非正态分布)。
为了确定该模式的敏感性和特异性,根据z变换的受试者评分绘制受试者工作曲线(ROC)。采用约登指数法[33]计算得出的最佳灵敏度和特异性临界值作为经验最佳临界值。接下来,进行Kaplan-Meier生存分析,使用模式表达值来估计从iRBD表型转化为显性α -突触核蛋白病的预测能力,模式表达值被分类为低于或高于先前由约登指数法计算的最佳切点。生存时间设定为[18F]FDG-PET与非转化患者最后一次随访之间的时间间隔,以及[18F]FDG-PET与转化患者表型转化之间的时间间隔,以月为单位。以年龄、性别和教育程度为协变量,采用Cox回归计算风险比(HR)。计算随时间变化的ROC曲线,比较各时间点的AUC(每12个月一个时间点,从第24个月至第84个月)。
然后,我们使用先前验证的iRBDconvRP截止点(0.6414)[15]作为最佳截止点进行相同的分析,以检查其在独立患者组中的可重复性。
统计阈值设为0.05,并采用Bonferroni方法对多重比较的p值进行校正。使用MatLab(版本2020a;MathWorks, Natick, MA, USA), R版本3.6.0 (R Foundation for Statistical Computing, Vienna, Austria)和Stata软件(StataCorp.)。2013. Stata统计软件:第13版。美国德克萨斯州大学城:StataCorp LP)。
治疗组iRBDconvRP表达z -score显著高于非治疗组(p=0.016,经验最优切割点=0.411;图1)。
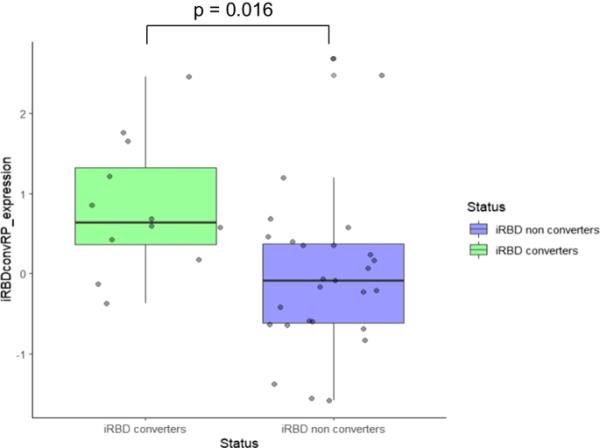
该图表示iRBDconvRP在首尔iRBD患者中的表达分布(z-score)。我们发现iRBDconvRP模式在转换者(绿色)患者中表达更高,而在非转换者(蓝色)患者中表达更低。这一结果证实了模式在转换和非转换之间的区分能力
在对转换者和非转换者的z分数进行ROC分析时,发现曲线下面积(AUC)为0.74(灵敏度:69%,特异性:78%,图2)。图3报告了Kaplan-Meier曲线,选择的经验最佳截止值为0.411。
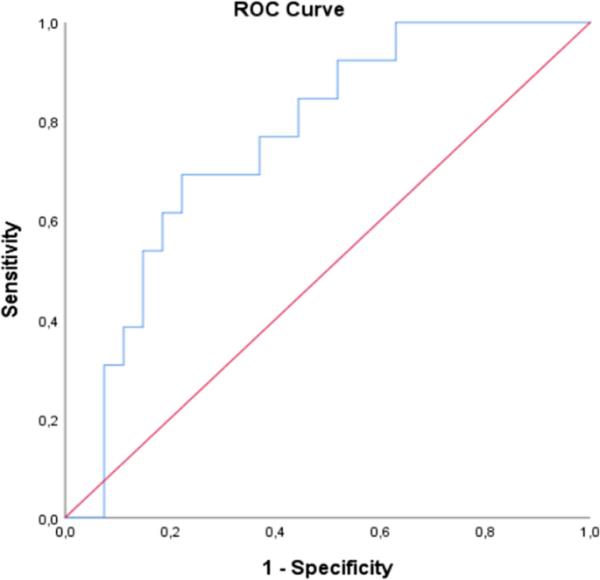
对个体z分数进行的ROC分析结果显示,区分转换者和非转换者患者具有良好的敏感性(69%)和特异性(78%),AUC为0.74。经验最优截断点为0.411
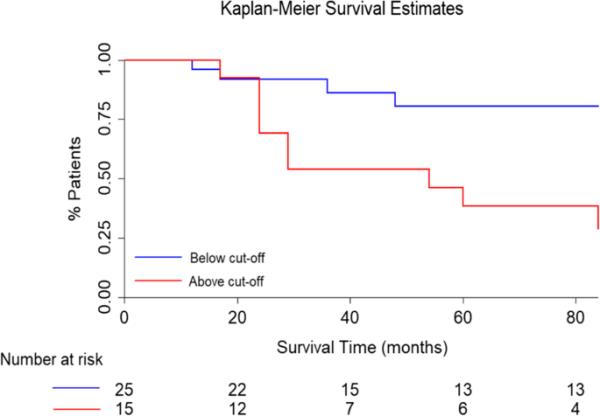
iRBDconvRP表达在首尔iRBD患者中的生存分析结果。iRBDconvRP表达低于经验最佳临界值(0.411)的iRBD患者用蓝色表示,iRBDconvRP表达高于经验最佳临界值(0.411)的iRBD患者用红色表示。该图显示,在随访中,表达该模式较高的患者倾向于以更高的概率转化
预测模型差异有统计学意义(p=0.012)。cox -回归分析显示,iRBDconvRP可显著预测iRBD患者的表型转化(校正后风险比为4.26,p=0.027, ci: 95%: 1.18-15.39)。
随时间变化的ROC分析显示整个随访期间AUC稳定(第24个月:AUC 0.78;第36个月:AUC 0.83;第48个月AUC 0.77;第60个月:AUC 0.81;第72个月:AUC 0.81;第84个月:AUC 0.83)。值得注意的是,在移除msa转换患者(n=1)后,结果没有明显变化。
当使用先前验证的iRBDconvRP最佳经验截止值(0.6414)进行分析时,灵敏度下降了46%,而特异性增加了85%。Cox回归分析仍然显著(p=0.025),但HR下降至3.36 (ci: 95%: 1.03-10.95)。
在这项研究中,我们交叉验证了先前发表的脑代谢模式,该模式反映了独立组iRBD患者从iRBD表型转化为显性α -突触核蛋白病(iRBDconvRP)的风险。我们的结果证实了iRBDconvRP的稳健性和可重复性。
大量研究表明,神经成像生物标志物对于诊断至关重要,在某些情况下,还可用于预测不同神经退行性疾病的临床轨迹[34]。需要确定可靠的表型转化生物标志物,以计划强大的临床试验,应用于神经退行性疾病的前驱期,如iRBD,这代表了疾病改善治疗的理想时间窗口[35,36]。
iRBDconvRP是一种与iRBD患者表型转化状态直接相关的脑代谢模式,包括小脑、脑干、前扣带皮层、颞中内侧和后中央区、慢状核的相对高代谢簇,以及扣带后、前叶、额叶中回和顶叶区的相对低代谢簇。在诊断时,该模式本身的表达可显著预测随访时(PD或DLB)表型转化为明显的α -突触核蛋白病,具有高HR(7.42)[15]。此外,与基线时有RBD证据的PD患者的脑代谢模式相比,iRBDconvRP显示出更好的预测能力[15]。这可能是由于iRBDconvRP比dnPDRBD-RP更能代表两种主要的表型转化诊断(即PD和DLB)。
当一种生物标志物在其他独立的群体中可复制和适用时,就被认为是可靠的和具有临床应用价值的。例如,PDRP已在几个国际队列中得到验证[37,38]。Schindlbeck等人(2020)[38]证实了PDRP作为早期PD生物标志物的重要性,他们报道了PDRP在一个意大利中心和一个美国中心招募的新发PD患者中表达异常升高,也证明了该模式在不同队列中的高可重复性。同样,Meles等人(2020)[37]在意大利、荷兰和西班牙患者中发现了PDRP,并随后对其进行了交叉验证,发现三种模式的地形重叠,证实了PDRP是PD的普遍特征。
以同样的方式,我们在首尔国立大学医学院(韩国)的一组独立的外部iRBD患者中交叉验证了iRBDconvRP,我们发现该模式在iRBD转换患者中比在非转换患者中表达得更多。iRBDconvRP也显著预测了疾病显性阶段的表型转化,具有良好的HR(4.26)。
尽管如此,由于iRBDconvRP是在一个独立的群体上验证的,而不是在原始的衍生群体上验证的,因此预期的HR较低。
另一个可能导致HR降低的因素是表型转化诊断的差异。事实上,iRBDconvRP来自一组不同类型的iRBD转换患者,主要是DLB(16例DLB vs. 14例PD),而在外部验证组中,iRBD患者主要表型转化为PD(7例PD, 5例DLB和1例MSA)。最后,这个复制组的样本量相对较小。即使考虑到在独立患者样本上验证生物标志物时预期的这些因素,iRBDconvRP显示能够预测外部独立患者组的表型转化,而无需先前的数据协调。此外,iRBDconvRP的表型转化预测能力仍然很高,是已发表的最佳预测因子之一[2,14]。
值得注意的是,在目前的研究中,32.5%的iRBD在平均35个月后表型转化为全面的α -突触核蛋白病。这一结果与最近的文献非常吻合[2,3],但值得注意的是,不同中心的表型转化率可能存在很大差异[39]。此外,本研究中的表型转化时间是根据[18F]FDG-PET计算的,而不是根据RBD诊断计算的,因此结果不能与其他以RBD诊断为基线的纵向研究直接比较。
虽然这项工作有一定的局限性,首先,病例数量有限,但是,本研究的样本量与已发表的使用神经成像生物标志物调查的iRBD患者队列一致。其次,必须强调的是,iRBDconvRP是在高加索患者队列中得出的,而在本研究中,它在亚洲患者队列中得到了验证。由于两组人群的种族差异,这可能降低了该模式的预测能力。另一方面,这也可以被认为是该研究的一个优势,因为尽管存在种族多样性,iRBDconvRP仍然证实了其在iRBD患者中显著预测表型转化的能力。这对于未来在世界范围内进行的临床试验至关重要,包括不同种族的患者。
总之,在这项研究中,我们证明了iRBDconvRP作为α -突触核蛋白病前驱期iRBD患者表型转化的生物标志物的可复制性。脑代谢模式的重要性已被证明不仅在诊断过程中特别有用,而且在神经退行性疾病的临床结果预测中也特别有用[11,14,37]。iRBDconvRP在识别短期表型转化高风险的iRBD患者方面显示出有希望的结果,但需要更大规模的多中心研究来进一步验证它。
下载原文档:https://link.springer.com/content/pdf/10.1007/s10072-023-06829-2.pdf
本文来自作者[志航]投稿,不代表文学号立场,如若转载,请注明出处:https://8ucq.com/wenxuehao/12120.html


评论列表(4条)
我是文学号的签约作者“志航”!
希望本篇文章《独立队列中快速眼动行为障碍表型转换相关模式的验证》能对你有所帮助!
本站[文学号]内容主要涵盖:文学号, 名著深析, 创作秘笈, 经典文脉, 诗词鉴赏, 作家故事, 每日文萃, 写作指南, 文本细读, 文学灯塔, 经典重释
本文概览:最近发现了一种与特发性/孤立性快速眼动睡眠行为障碍(iRBDconvRP)患者表型转化相关的脑葡萄糖代...