肥胖的黑棕色短尿(BTBR) ob/ob小鼠自发发展出与人类糖尿病肾病相似的特征。本研究的主要目的是研究含有鱼蛋白的饮食是否会减轻或延缓肥胖BTBR ob/ob小鼠肾小球肥大(肾小球肿大)、系膜硬化和蛋白尿的发展。
肥胖BTBR。CgLepob/ wisj雄性小鼠分别饲喂25%大西洋鳕鱼脊骨蛋白和75%酪蛋白(cod - bb组)或酪蛋白作为唯一蛋白质来源(对照组)的饲粮。对肾脏进行形态学分析,并对尿液和血清中的肾功能障碍标志物进行生化分析。
Cod-BB饮食减轻了系膜硬化的发展(P < 0.040),但没有影响肾小球肥大和蛋白尿的发展。饲喂Cod-BB日粮的小鼠尿胱抑素C浓度(相对于肌酐)较低(P < 0.0044)。
含有鳕鱼脊骨蛋白粉的饮食可以减轻肥胖BTBR ob/ob小鼠肾小球硬化和小管功能障碍的发展,但不能阻止这些小鼠肾小球肥大和蛋白尿的发展。
肥胖是慢性肾脏疾病发展的独立危险因素,对肾小球肥大和局灶节段性肾小球硬化的进展有不利影响[1,2,3]。建议患有慢性肾衰竭的儿童和成人患者遵循适度限制蛋白质的饮食,以限制尿毒症和其他代谢并发症的发生[4],但该建议并未区分不同来源的蛋白质。关于不同类型的膳食蛋白质如何影响肾功能,特别是对肾功能受损风险较高的个体,目前知之甚少,动物模型研究可能是获得此类信息的有价值的工具。鱼类是蛋白质和必需氨基酸的极好来源,在普通人群[5]和1型糖尿病患者[6]中,摄入鱼类与降低患肾脏疾病的风险有关。
肾脏通过氨基酸和多肽的合成、降解、过滤、重吸收和尿排泄,在氨基酸稳态中发挥重要作用,是氨基酸和蛋白质代谢的重要调节因子[7]。必需氨基酸色氨酸主要通过肝脏中的犬尿氨酸途径代谢[8];然而,相当数量的色氨酸进入结肠并被肠道微生物降解为多种吲哚[9]。虽然犬尿氨酸的几种代谢物具有神经毒性,包括喹啉酸和吡啶酸[8],但吲哚通常被认为是有益的,除了尿毒症毒素吲哚-3-硫酸盐,它是吲哚的代谢物[9]。吲哚基-3-硫酸盐可被近端小管清除,慢性肾病患者血液循环中吲哚基-3-硫酸盐浓度较高,可预测肾脏进展[10]。慢性肾病或继发于2型糖尿病的糖尿病肾病患者体内犬尿氨酸途径代谢物的循环浓度发生改变[11,12,13],且浓度受鱼类摄入量的影响[14,15]。到目前为止,鱼类摄入对吲哚(包括吲哚-3-硫酸盐)的影响尚未在人类或啮齿动物中进行过研究。
我们之前研究了鱼类或鱼类蛋白摄入对肥胖Zucker fa/fa大鼠的影响。这些大鼠瘦素抵抗,自发出现类似于人类代谢综合征的肥胖代谢并发症,包括胰岛素抵抗、轻度葡萄糖耐受不良、高胰岛素血症、血脂异常和高血压,以及蛋白尿和局灶节段性肾小球硬化导致肾功能衰竭[16,17]。当给肥胖的Zucker fa/fa大鼠喂食含有冻干鱼肌或鱼渣蛋白粉的饲料时,我们观察到餐后葡萄糖调节得到改善[18,19],高血压的发展得到缓解[20,21,22,23],肾功能障碍的发展得到延缓[20,24,25,26]。
血压升高与慢性肾脏疾病的风险增加有关[27],在研究鱼类蛋白摄入对肥胖Zucker fa/fa大鼠肾功能的影响时,很难评估观察到的任何影响是直接影响还是继发于血压升高的衰减。因此,在本研究中,我们想研究鱼类蛋白摄入对黑褐短尿酸(BTBR)小鼠的影响,这些小鼠瘦素缺乏并自发发生肥胖[28],但与野生型BTBR相比,它们具有低血压[29]。BTBR ob/ob雄性在6周龄前自发发生高血糖,为严重的2型糖尿病[28],并模拟人类糖尿病肾病[29]。由于肥胖和糖尿病,BTBR ob/ob雄性小鼠在8周龄时出现肾小球肥大和系膜硬化(系膜基质积聚),9周龄时出现蛋白尿,12周龄后出现间质纤维化[29]。据我们所知,鱼类蛋白摄入对肥胖相关肾小球病变和糖尿病肾病的发展和严重程度的影响从未在BTBR ob/ob小鼠中进行过研究。作为瘦对照,我们使用BTBR T+ Itpr3tf/J小鼠。由于鱼类摄入与人类发生肾脏疾病的风险降低有关[5,6],本研究的主要目的是研究含有鱼类蛋白的饮食是否会减轻或延缓肥胖BTBR ob/ob小鼠肾小球肥大(肾小球肥大)、系膜硬化和蛋白尿的发展。次要目的是研究Cod-BB对犬尿氨酸途径代谢物和色氨酸产生的吲哚的影响,并探讨肥胖和瘦BTBR菌株在这些因素方面的差异。我们的假设是,摄入含有Cod-BB的饮食会减轻BTBR ob/ob小鼠肾小球肥大、系膜硬化和蛋白尿的自发发展。
研究方案由国家动物研究管理局(挪威)根据动物福利法和动物实验条例(批准号23928)批准。所有适用的国际、国家和机构的动物护理和使用准则都得到遵守。
大西洋鳕鱼(Gadus morhua)于2020年4月在挪威罗弗敦外的挪威海被捕获。切片后的骨干残留物冷冻保存在- 23°C,直到在Nofima制备。将骨干部分解冻,在约15℃下过夜,粗磨,加水(重量比4:1),加热至85℃,持续搅拌,在此温度下保存10 min。将热凝固的原料冷冻冻干,干燥后的产品在Retsch滚磨机(孔径0.75 mm)上研磨。所得鳕鱼骨干粉常温保存,待分析配制小鼠日粮。
进行了两次小鼠实验。16肥胖BTBR。CgLepob/ wisj纯合子雄性小鼠(JAX stock #004824)和16只精瘦BTBR T+ Itpr3tf/J雄性小鼠(JAX stock #002282)从美国杰克逊实验室获得。BTBR T+ Itpr3tf/J小鼠(以前称为BTBR T+ tf/J小鼠)来源于BTBR (Black and Tan BRachyury)近交系和BTBR。CgLepob/ wisj系由BTBR T+ Itpr3tf/J组合而成,其中ob等位基因来自B6。V-Lepob/J是渐渗的。在这些条件下,小鼠至少适应了7天,在适应期间,两只肥胖的BTBR小鼠无任何明显原因死亡。对照组2只肥胖BTBR小鼠在干预期间因肾功能衰竭和健康状况极差而被安乐死。因此,我们选取了12只肥胖BTBR小鼠和16只瘦BTBR小鼠进行生化和形态学分析。将各品系小鼠按出生日期进行分层,然后抽签随机分为对照组和Cod-BB组。将小鼠置于GM500 Mouse IVC Green Line (Tecniplast, Buguggiate, VA, Italy)中(3-4只/笼),用塑料冰棚遮挡,GM500925给粉器(Tecniplast),标准条件23-25℃,明暗循环12 h。
改良半纯化饲料是根据美国营养研究所对实验室生长啮齿动物的推荐标准(AIN-93G)[30]制备的,添加Reeves推荐的1.6 g蛋氨酸/kg饲料[31],仅在蛋白质来源上有所不同(表1)。两种饲料均含有20%的蛋白质。由于小鼠在干预开始时处于生长期,因此使用AIN-93G日粮代替ain - 93m日粮维持蛋白质含量为15%。此外,由于蛋白质降解速度更快,而不是蛋白质合成受损,ob/ob小鼠的骨骼肌生长速度比瘦窝鼠慢[32],因此确保足够的蛋白质摄入以维持生长速度非常重要。酪蛋白是对照组饮食中唯一的蛋白质来源。在鳕鱼- bb日粮中添加鳕鱼骨干蛋白粉,添加量占总蛋白质的25%,酪蛋白占其余75%。在对照日粮中添加氯化钠,以弥补鳕鱼脊骨蛋白粉中钠含量高于酪蛋白的缺陷,使两种日粮中的钠含量均为0.3%。除酪蛋白和氯化钠(p.a)购自德国慕尼黑的Sigma-Aldrich公司,鳕鱼脊骨蛋白粉购自挪威卑尔根的Nofima公司外,所有原料均购自美国染料公司(Bethlehem, PA, USA)。肥胖和瘦弱的BTBR小鼠都使用了相同批次的饲料。日粮保存在- 26°C,每日部分在早上解冻。
首先在瘦BTBR小鼠身上进行了50天的试验。当同样的实验设计应用于肥胖BTBR小鼠实验时,很明显,两组饮食中这些小鼠的健康状况都在迅速下降,我们决定在30天后终止干预。所有小鼠自由进食,并可自由获得饮用水和白杨咬块。两项实验中的小鼠在干预开始时都是大约9周大。两种小鼠实验均记录每日采食量。在肥胖的BTBR小鼠中,每天记录饮水量,以检测任何突然增加的饮水量,因为这可能表明糖尿病和/或肾功能衰竭的发展。在瘦BTBR小鼠中,在干预的最后一周测量48小时的饮水量。在安乐死前3-4天,将小鼠单独置于代谢笼中收集尿液4小时,事先不禁食。尿液样本在- 80°C冷冻直至分析。实验结束时,小鼠从上午8:30开始禁食4-5小时,可自由饮水,并在异氟醚(Isoba vet, Intervet, Schering-Plough Animal Health, Boxmeer, the Netherlands)混合氧气麻醉下安乐死。用尺子测量体长,同时麻醉小鼠。用注射器从心脏抽血,离心,血清在- 80°C冷冻。取左肾,切成1 - 2mm厚横切片,4%缓冲甲醛固定,形态学检查。仔细解剖两侧附睾白色脂肪组织(WATepi)并称重。
处理小鼠和进行分析的人员对小鼠的组分配不知情。这些老鼠被随机处理和安乐死。
采用Nofima BioLab(卑尔根,挪威)测定了日粮中氨基酸、脂肪酸和能量的含量以及鳕鱼骨干蛋白粉中氨基酸、总脂肪、水分和灰分的含量。氨基酸在6 N HCl中110℃水解22 h,与6-氨基喹啉-N-羟基琥珀酰氨基甲酸酯衍生化后,用高效液相色谱法测定,在250/395 nm激发/发射荧光检测衍生物[33]。色氨酸的化学测定方法为Miller[34]。氯仿/甲醇萃取后用重量法测定脂肪含量[35]。在103±1°C的强制空气烘箱中干燥4.5 h后,用重量法测量水分含量[36]。按照Bligh和Dyer[35]的描述,提取脂质后,采用气相色谱法[37]分析饲料的脂肪酸组成。在550℃下焚烧后用重量法测定总灰分[38]。根据iso931:1998[39],用炸弹量热计法测定膳食热量。根据ISO 11885:2007 [40], Eurofins (Moss, Norway)采用电感耦合等离子体发射光谱法对酪蛋白和鳕鱼骨架蛋白粉中的钠进行了定量。
固定肾片按标准程序处理,石蜡包埋。3微米厚的切片用周期性酸性希夫染色。用ScanScope?XT (Aperio)以40倍的分辨率扫描载玻片,分辨率为0.25μm / pixel。在ImageScope v12.4中查看虚拟幻灯片。所有显微镜检查均采用盲法进行。
通过HistoCloud工具[41]从整个幻灯片图像中自动检测和分割肾小球,该工具可通过Sarder Lab slide Analyzer (https://athena.ccr.buffalo.edu/histomics)获得。生成的注释被提取为。Json文件(每个幻灯片图像一个),共包含6317个检测。在某些情况下,两个相邻的肾小球被注释为单个物体或注释不完整或碎片化。为了自动删除这种情况,假定的小球的每个注释被转换为二进制掩码,然后进行一系列形态学打开,距离变换和阈值处理(使用python中的OpenCV库),从而识别出30个注释,可能包括多个对象或不完整/碎片的注释,这些注释从下游分析中删除。随后,Python库成形。利用几何学将剩下的6287个注释解释为多边形,并计算它们各自的面积。
为了评估各组之间系膜肾小球硬化的差异,每只小鼠随机选择50个肾小球。由此产生的1400个肾小球(按随机顺序排列)分别被分为(1)有或(2)没有系膜硬化。对于每只小鼠活检的50张图像,计算肾小球与系膜硬化的百分比,并用于比较小鼠组。
尿白蛋白浓度测定采用LifeSpan BioSciences, Inc. (Seattle, WA, USA)的LSBioTM小鼠白蛋白/血清白蛋白ELISA试剂盒(LS-F10450)。尿液胱抑素C采用明尼苏达州R&D Systems公司的小鼠/大鼠胱抑素C定量因子?ELISA (MSCTC0)进行定量。两种方法的所有样品在同一板上同时分析,并在SpectraMax Plus384微孔板读取仪(Molecular Devices)上在450 nm处读取。这些试验的方差系数(cv)分别为8.1%和2.6%。尿肌酐、尿酸、尿素和葡萄糖浓度以及血清肌酐和尿素浓度在Cobas c111系统(罗氏诊断有限公司,曼海姆,德国)上进行分析,使用罗氏诊断公司的CREP2(肌酐加ver.2)、UA2(尿酸ver.2)、UREAL(尿素/尿素)和GLUC2(葡萄糖HK)试剂盒。这些分析在Cobas系统上的日间cv值为1.7-5.5%。如先前所述[42],Bevital AS(卑尔根,挪威,http://www.bevital.no)使用液相色谱结合串联质谱法分析血清中的色氨酸、犬尿氨酸、犬尿酸、黄嘌呤酸、维生素B2(核黄素和黄素单核苷酸)和维生素B6(吡哆醛5 ' -磷酸)。将喹啉酸[43]、吡啶酸[44]、喹啉酸[45]、吲哚-3-硫酸盐、吲哚-3-丙酸、吲哚-3-乳酸、吲哚-3-乙酸、吲哚-3-醛和吲哚-3-乙酰胺与相应的同位素标记内标添加到先前发表的测定方法[42]中。所有样本按随机顺序进行分析。上述方法的测定精度对应于2.8-9.5%的日内CV和4.9-16.9%的日间CV,如其他地方详细描述[42,43,44,45]。
研究的主要结果是研究饮食中摄入含有大西洋鳕鱼脊骨蛋白的饮食对年轻肥胖BTBR ob/ob小鼠肾小球改变和蛋白尿的影响。次要目的是研究Cod-BB对犬尿氨酸途径代谢物和色氨酸产生的吲哚的血清浓度的影响,并研究肥胖和瘦BTBR小鼠之间的差异。
本研究是第一个研究含有鱼蛋白粉的饮食对BTBR肾脏功能障碍发展影响的研究。CgLepob / WiscJ老鼠。因此,在本研究中,没有关于效应量的数据可用于样本量计算或最低可检测效应量。根据我们之前的研究经验,研究中使用含有鱼类蛋白质的饮食对肥胖Zucker fa/fa大鼠的肾脏功能和肾功能障碍标志物的影响,每组8只小鼠[20,21,24,25,26]。
统计比较平均肾小球大小或百分比的肾小球系膜硬化组老鼠之间,使用未配对,双尾韦尔奇的t测试,进行了t测试函数r .所有其他统计分析进行了使用SPSS统计版本28 (SPSS, Inc ., IBM公司,阿蒙克,纽约,美国)。使用Shapiro-Wilk检验、Q-Q图和直方图评估空腹血清浓度和尿浓度(相对于肌酐)是否正常。大多数变量不是正态分布;因此,在进行参数统计检验之前,所有变量都进行了对数变换。使用配对样本T检验来检测组内基线到终点的变化,使用独立样本T检验来比较品系内饮食组之间以及喂食对照饮食的肥胖和瘦小鼠之间的终点测量值。统计学显著性的截断值设为0.05的概率。由于每个实验只包括两个笼子的数据,因此没有对单个小鼠的饮食组之间的能量摄入量和水摄入量进行统计分析。
摘要
介绍
方法
结果
讨论
参考文献
致谢
作者信息
道德声明
补充信息
搜索
导航
#####
两种饲料中必需氨基酸含量相似,偏差均≤0.1 g/100 g(表2)。二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)仅在鳕鱼- bb饲料中存在(表2)。两种饲料的能量含量相似(差异< 2%,表2)。
在整个干预期间,每天记录肥胖BTBR小鼠的采食量(图1a),显示对照组和Cod-BB组小鼠的累计平均采食量分别为3147 kJ和3056 kJ。10-11天后,每只小鼠的采食量从70-80千焦/24小时急剧增加到115-120千焦/24小时左右,然后稳定在105 - 120千焦/24小时之间。对于瘦BTBR小鼠,从干预的第8天到安乐死的那一天,每天记录采食量(第50天,图1c)。在干预期间变化不大,对照组和Cod-BB组每只小鼠的累计平均摄入量分别为2636千焦和2751千焦。
在整个干预期间,每天记录肥胖BTBR小鼠的饮水量(图1b),显示两组饮食组的饮水量都有增加的趋势,在干预约10天后达到峰值,这与饲料摄入量的情况非常相似。虽然我们的观察太少,无法进行统计测试,但在干预的第8天至第15天,对照组小鼠的饮水量似乎比Cod-BB组更明显。对照组每只老鼠的累计饮水量也更高;670 g,而Cod-BB组为581 g。瘦BTBR小鼠实验的平均每日饮水量在饮食组之间差异不大(图1d)。
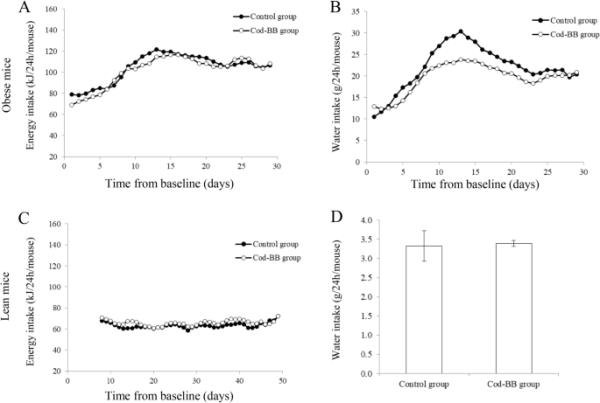
肥胖BTBR小鼠的能量摄入量(a)和水摄入量(b),瘦弱BTBR小鼠的能量摄入量(c)和水摄入量(d)。能量摄入量(A, C)和水摄入量(b)以3天移动平均值的形式呈现(以过滤掉随机的每天变化),因为登记不是在每天的同一时间进行的。d为干预期结束时48 h记录的平均值和标准差。由于每个实验组只有两个笼子,因此没有对单个小鼠实验中饮食组之间的能量摄入量和水摄入量进行统计分析
肥胖BTBR小鼠的体重在基线和干预2、3和4周后的饮食组之间相似(图2a)。Cod-BB组从基线到终点的总体重增加更高(P 0.0056,图2b),而两组之间的体重与体长之比或附睾白色脂肪组织的相对重量没有差异(表3)。
在基线(第0周)和喂食对照饮食或Cod-BB饮食的肥胖小鼠(a)和瘦小鼠(c)的每周体重测量,以及肥胖小鼠(b)和瘦小鼠(d)的总体重增加。数值为肥胖试验组n 6和瘦肉试验组n 8的几何平均值,标准差用竖条表示,假设方差相等,采用独立样本t检验评估
在瘦BTBR小鼠中,在基线或任何每周测量时,Cod-BB组与对照组的登记体重没有差异(图2c),两组之间的总体重增加(图2d)和体重与体长的平方比(表3)相似。精瘦BTBR小鼠实验中,各饮食组间附睾白色脂肪组织的相对重量相似(表3)。
肥胖BTBR小鼠与饲喂对照饲料的瘦BTBR小鼠相比,肥胖BTBR小鼠的体重与体长的平方比和相对附睾白色脂肪组织的重量明显更高(表3)。与瘦BTBR小鼠相比,肥胖BTBR小鼠由于瘦素缺乏而嗜食,其体重和脂肪含量更高,其日饲料和水的摄入量也更高。
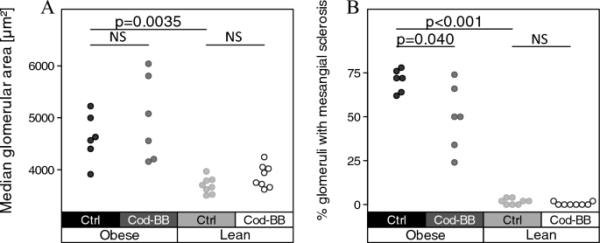
Cod-BB饮食不影响肥胖BTBR小鼠肾小球肥大的发展(图3a和补充图1);然而,与喂食对照组的肥胖小鼠相比,喂食Cod-BB饮食的肥胖BTBR小鼠肾小球肾小球系膜硬化的百分比明显较低(图3b)。

肥胖和瘦BTBR小鼠肾小球大小和系膜硬化。a中的条形图显示了每种情况下肾小球中位大小的分布;每个点表示为整个幻灯片图像计算的中位数大小。b中的条形图显示了肾小球伴系膜硬化的百分比;每个点代表单个小鼠肾脏的百分比,基于50个检查的肾小球。P值代表非配对双尾Welch 's t检验的结果。NS不显著
肥胖和瘦弱的BTBR小鼠均未表现出肾小管萎缩、间质纤维化、节段性或全局性肾小球硬化的迹象。当肥胖和瘦弱的BTBR小鼠饲喂对照饲料进行比较时,与瘦弱的BTBR小鼠相比,肥胖的BTBR小鼠肾小球的中位大小明显更大(图3a),肾小球肾小球肾小球肾小球硬化的百分比明显更高(图3b)。补充图2显示了瘦BTBR小鼠正常肾小球和肥胖/糖尿病BTBR小鼠肾小球系膜硬化的代表性图像。
在肥胖BTBR小鼠中,与对照组相比,Cod-BB组尿胱抑素C(相对于肌酐)浓度显著降低(表4),表明肾小管功能障碍减弱。含氮化合物白蛋白、尿素和尿酸的尿浓度(相对于肌酐)在Cod-BB组和对照组之间相似(表4)。两种饮食组肥胖BTBR小鼠之间的尿葡萄糖浓度差异很大(对照组肌酐为4.5-1395 mmol/mmol, Cod-BB组肌酐为3.0-585 mmol/mmol),可能是由于小鼠没有同时发生糖尿病,且程度相似。组间比较差异无统计学意义(表4)。肥胖实验中各饮食组间血清肌酐和尿素浓度相似(表4)。
与对照组相比,饲喂Cod-BB日粮的瘦体BTBR小鼠的尿白蛋白浓度(相对于肌酐)显著降低(P 8.2 × 10-5),尿尿素相对浓度有降低趋势(P 0.050)(表4)。瘦体BTBR小鼠的尿胱抑素C、尿酸和葡萄糖相对浓度以及血清肌酐和尿素浓度在各组之间相似(表4)。
肥胖BTBR小鼠的白蛋白、胱抑素C、尿素、尿酸和葡萄糖的尿浓度(相对于肌酐)明显高于饲喂对照饲料的瘦BTBR小鼠(表4)。肥胖BTBR小鼠和瘦BTBR小鼠的血清肌酐和尿素浓度相似。
饲喂Cod-BB日粮的肥胖小鼠的色氨酸浓度高于对照组,但肥胖组之间犬尿氨酸和吲哚含量没有差异(表5)。饲喂Cod-BB日粮的瘦小鼠的犬尿氨酸/色氨酸比高于对照组,血清醌酸浓度低于对照组,两组之间犬尿氨酸和吲哚浓度相似(表5)。肥胖小鼠血清色氨酸、吡啶酸、喹啉酸、核黄素、黄素单核苷酸、吡哆醛5′-磷酸和所有测量的吲哚浓度较高,黄嘌呤酸浓度较低,其他犬嘌呤组间无差异(表5)。
下载原文档:https://link.springer.com/content/pdf/10.1007/s00394-023-03227-4.pdf
本文来自作者[芙蒙]投稿,不代表文学号立场,如若转载,请注明出处:https://8ucq.com/wenxuehao/11083.html


评论列表(4条)
我是文学号的签约作者“芙蒙”!
希望本篇文章《含有鳕鱼骨架蛋白的饮食减轻了雄性肥胖BTBR ob/ob小鼠系膜硬化和小管功能障碍的发展》能对你有所帮助!
本站[文学号]内容主要涵盖:文学号, 名著深析, 创作秘笈, 经典文脉, 诗词鉴赏, 作家故事, 每日文萃, 写作指南, 文本细读, 文学灯塔, 经典重释
本文概览:肥胖的黑棕色短尿(BTBR)ob/ob小鼠自发发展出与人类糖尿病肾病相似的特征。本研究的主要目的是研...