创伤性脑损伤(TBI)的药物开发一直受到疾病病理复杂性和异质性的阻碍,以及对初始创伤后继发性损伤级联的了解有限。因此,TBI患者对有效药物治疗的需求尚未得到满足。一种有希望的候选药物是环孢素,一种传统上用于移植受者免疫抑制的多肽。环孢素抑制线粒体通透性转变,从而减少继发性脑损伤,并在多个TBI临床前模型中显示出神经保护作用。此外,在哥本哈根头部损伤环孢素试验(NCT01825044)中,环孢素制剂NeuroSTAT?对重度TBI患者的损伤生物标志物水平显示出积极的影响。未来对神经保护化合物(如环孢素)的研究应利用基于液体的生物标志物和神经影像学的最新进展,选择具有相似疾病病理的患者进行临床试验。这将提高统计能力,并允许对长期结果进行更准确的评估。
创伤性脑损伤(TBI)是造成死亡和残疾的主要原因。在全球范围内,每年有超过5000万人患有TBI[1]。创伤性脑损伤给社会带来的死亡率和发病率负担使其成为一个紧迫的公共卫生问题。
TBI被定义为“由外力引起的脑功能改变或其他脑部病理证据”[2]。根据外力的性质,它可以大致分为漫射或聚焦。然而,这些分类简化了具有多种重叠损伤亚型的复杂疾病过程[3]。疾病病理和临床过程的异质性对TBI神经保护疗法的发展提出了重大挑战,导致缺乏临床证实的药物干预措施。
TBI药物开发的另一个障碍是理解和解决初始损伤后继发性损伤级联反应的复杂性。弥漫性轴索损伤(DAI)是一种常见的TBI,已经描述了这种损伤级联的一个例子。在DAI中,神经元由于高速平移或旋转力而发生剪切、拉伸或其他损伤。轴突通过沃勒氏变性对这些机械力和次生损伤作出反应[4]。受损神经元的膜极化和离子稳态被破坏,氧化应激增加。由于微管断裂,神经丝变得紧致,轴突运输受损。由于钙超载和氧化应激,线粒体通透性过渡孔(mPTP)形成,增加线粒体膜的通透性,最终导致不可逆的神经元损伤和脑萎缩,这在几种类型的损伤中很常见[5,6]。如果我们能够通过防止从可逆损伤到轴突断开的过渡来减轻创伤性脑损伤后的继发性损伤级联,那么我们就有机会限制创伤后神经变性和发病率的程度[7]。
几十年来,环孢素一直用于器官移植受者的免疫抑制。事实上,在实验性前脑缺血模型中,它被用作免疫抑制剂防止海马移植物排斥反应时,偶然发现了其强大的神经保护作用[8,9]。从那时起,环孢素在广泛的神经损伤和疾病动物模型中显示出神经保护作用,这种作用与其通过阻止mPTP形成来稳定线粒体功能的能力有关[10,11,12]。在实验性创伤性中枢神经系统损伤模型中,环孢素、环孢素类似物以及调节mPTP形成的遗传工具已被广泛探索[13]。在这里,我们总结了NeuroSTAT?(也被称为CicloMulsion?)的临床前和临床开发,这是一种新的环孢素肠外制剂,旨在避免与Kolliphor EL?相关的过敏反应风险,Kolliphor EL?被用作其他环孢素产品(如Sandimmune?)的辅料[14]。NeuroSTAT?已获得美国和欧洲监管机构的认可,被授予孤儿药资格,用于治疗中度至重度TBI(美国食品和药物管理局指定10-3197,欧盟指定EU/3/10/791)。
在一系列不成功的介入临床试验之后,在过去的几十年里,大量的自然历史研究项目试图提高TBI分类和诊断的准确性,标准化数据收集,并开发和验证相关的临床结果测量方法[15,16,17]。治疗性临床试验的下一个时代将能够利用这些努力来更好地针对具有疾病病理的TBI患者的定义亚组,这些患者可能从测试干预中受益。具体来说,使用成像和基于液体的生物标志物可以帮助选择具有特定疾病病理类型的患者和监测药物的药效学效应。
在本文中,我们总结了环孢素神经保护作用的分子基础,并回顾了支持环孢素在创伤性脑损伤中的应用的临床前和临床证据。最后,我们将着眼于继续开发神经保护化合物的机会,如环孢素治疗创伤性脑损伤,鉴于生物标志物和成像的最新进展。
环孢素是一种由11个氨基酸组成的环状多肽,其药理靶点是亲环蛋白,这是一种在细胞过程中起不同作用的酶家族。其目前在器官移植和自身免疫性疾病中的治疗用途是通过与亲环蛋白a结合介导的。这种结合抑制t辅助细胞中的钙调磷酸酶活性,并在细胞介导的免疫反应中阻止淋巴因子的释放和t细胞的增殖[18]。
环孢素及其类似物在几种急性和慢性神经系统疾病模型中显示出神经保护特性。其神经保护作用被认为主要是通过抑制另一种调节mPTP的亲环蛋白——亲环蛋白D来介导的[19]。环孢素抑制mPTP激活的能力已在啮齿动物和人脑线粒体中得到证实[20,21,22]。在TBI中,通过药物治疗或基因敲除亲环蛋白D抑制mPTP可降低线粒体损伤、病变体积、轴突内细胞骨架破坏和脑损伤生物标志物水平(见表1)。
来自各种TBI体内模型的数据提供了环孢素在机制、组织学和行为终点上的神经保护作用的证据(表1)。在不同的TBI模型中,包括啮齿动物和大型动物,已经完成了30多项环孢素的独立实验研究。环孢素的神经保护作用已在DAI的冲击加速动物模型、主要局灶性损伤模型(皮质挫伤)和局灶性脑损伤合并DAI的实验(TBI的液体撞击模型)中进行了评估。给药方案从单次给药到连续输注数天不等,损伤后评估的时间点从数小时到数周不等,取决于结果测量。一些研究严格评估了最佳给药方案。例如,在大鼠冲击加速模型中,10 mg/kg(损伤后1小时内输注)是减轻轴突损伤最有效的环孢素剂量,损伤后24小时显示淀粉样前体蛋白免疫反应性的受损轴突平均密度降低79%[23]。在一系列评估大鼠CCI损伤后环孢素的最佳剂量和给药方案的论文中,最初的腹腔内负荷剂量为20mg /kg,然后立即连续7天皮下输注10mg /kg,具有最大的神经保护作用,第7天病变体积减少了74%[24,25]。总的来说,大多数体内研究已经证明环孢素对评估结果的有益作用。一些研究发现环孢素对TBI无效或有负面影响(表1)。剂量和给药时间与给药途径的关系已被讨论为这些发现的潜在原因[13]。此外,在一项使用大鼠穿透弹道样脑损伤模型的研究中,我们得出结论,环孢素的载体导致了观察到的对结果测量的负面影响[26]。然而,体内研究共同表明,环孢素通过以下方式发挥神经保护作用:(i)保持线粒体功能和形态,(ii)维持轴突/细胞骨架的完整性,(iii)减少由TBI激活或在TBI中运作的蛋白水解过程的程度,(iv)最小化创伤灶的体积,以及(v)保持挫伤周围的活力。
如表1所示,已在几种不同的TBI模型(主要是啮齿动物)中评估了不同配方环孢素的治疗潜力。与啮齿类动物模型相比,仔猪模型与人类更相关,因为与啮齿类动物的大脑相比,具有gyrencephalic的猪大脑在解剖学、生长和发育方面与人类大脑更相似。在一项随机、全盲研究中,使用仔猪控制皮质冲击(CCI) TBI模型评估了NeuroSTAT环孢素制剂的疗效。这项仔猪研究旨在探讨NeuroSTAT治疗是否会影响脑实质损伤的体积,以及神经元完整性和轴突损伤的标志物。基于先前动物模型中对最佳给药方案的评估([24,25],见上文讨论)以及临床研究的初步信号([27,28],见下文),我们决定将NeuroSTAT连续输注5天。图1总结了该研究的一些转译结果指标。与安慰剂(n=13)相比,NeuroSTAT (20 mg/kg/天,n=11)使皮质和皮质下病变体积减少35%[29]。磁共振弥散张量成像获得的各向异性分数显著提高证明,挫伤周围区域的轴突损伤也减轻了[30]。CCI后5天,损伤和正常脑实质脑区神经元活力代谢物的光谱成像显示,与安慰剂治疗的动物相比,接受neurostat治疗的动物的n -乙酰天冬氨酸、γ -氨基丁酸、磷酸肌酸和牛磺酸的平均水平显著提高。神经纤维光(NF-L)是轴突损伤的生物标志物,与安慰剂治疗的动物相比,neurostat治疗的动物血清和脑脊液(CSF)中的神经丝光(NF-L)水平也显示出较低的趋势。因此,研究表明,CCI后连续输注NeuroSTAT 5天可减少仔猪继发性脑损伤。
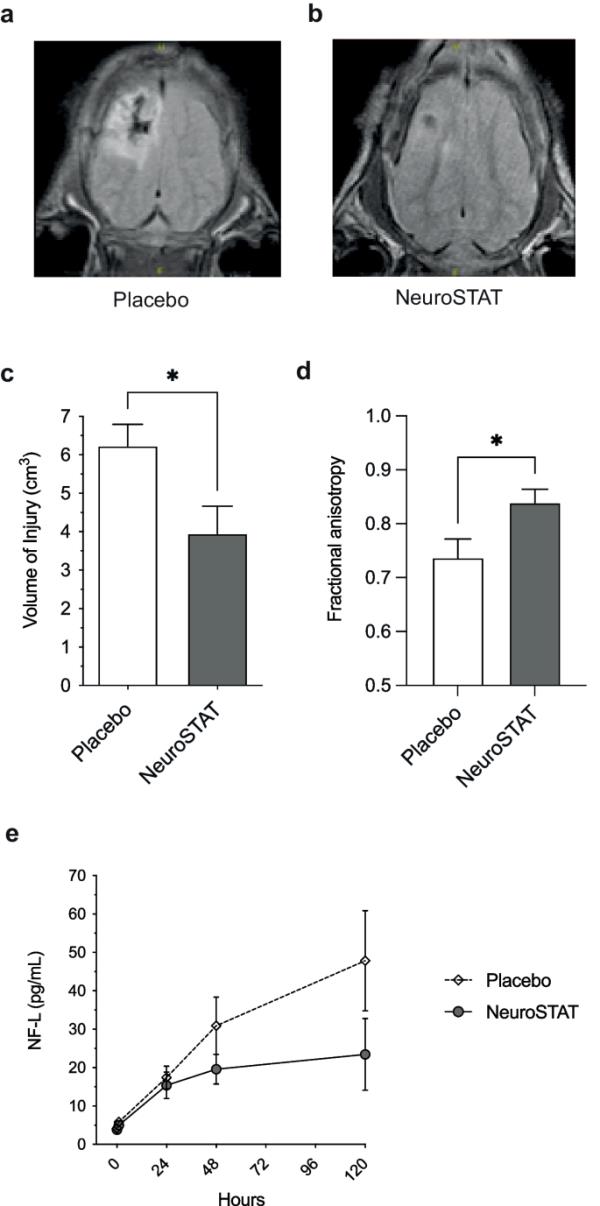
NeuroSTAT在控制皮质撞击损伤仔猪研究中的转化疗效结果。损伤后第5天的神经影像学显示:neurostat治疗组的A磁共振成像解剖图像代表中位损伤,安慰剂组的B。C由委员会认证的神经放射学家在盲法治疗组的FLAIR成像上对信号异常增加的每片区域进行手工追踪测量的损伤体积。D扩散张量成像在挫伤周围组织中的分数各向异性。E损伤后第1 ~ 5天血清神经丝光(NF-L)变化。数据以平均值和扫描电镜表示。* p < 0.05。经出版商许可改编自[29,30]
摘要
介绍
环孢素的分子和细胞效应
环孢素的临床前研究
环孢素治疗脑外伤的临床研究
NeuroSTAT的临床发展
未来的发展方向
结论
参考文献
致谢
作者信息
道德声明
搜索
导航
#####
表2总结了环孢素在TBI中的临床研究。商业环孢素制剂按名称命名;其他制剂统称为“环孢素”。
在Young及其同事进行的环孢素随机双盲试验中,严重TBI患者(格拉斯哥昏迷量表[GCS] 4-8)被分配到四个剂量队列中的一个(安慰剂n=2,环孢素n=8): 0.625、1.25或2.5 mg/kg,每12小时输注2小时(6剂),或2.5 mg/kg负荷剂量,然后5 mg/kg/天连续输注72小时。在3个月和6个月时评估疗效。虽然格拉斯哥结局量表(GOS)和格拉斯哥结局量表扩展(GOSE)评分在安慰剂和环孢素治疗的患者之间没有显着差异,但环孢素在不同剂量队列中显示出改善功能结局的趋势。在6个月的评估中,35%的环孢素治疗患者和0%的安慰剂治疗患者的结果评分从差改善到好。此外,连续输注72小时的患者比每12小时单独输注一次的患者有更高的可能性获得良好的功能结果。环孢素和安慰剂之间的死亡率和严重不良事件(SAEs)的发生率没有显著差异。感染患者和肝功能检查结果异常的百分比在两种治疗之间也具有可比性[27]。
在Bullock及其同事进行的另一项随机双盲试验中,严重TBI患者(GCS 3-8)以3:1随机分配至环孢素5 mg/kg或安慰剂组。治疗持续输注超过24小时。接受环孢素治疗的患者脑外细胞液中葡萄糖、乳酸和丙酮酸水平明显高于接受安慰剂治疗的患者。相反,在研究药物输注结束后1 - 2天,安慰剂组谷氨酸水平显著高于环孢素组,在研究药物输注结束后2 - 3天,安慰剂组乳酸/丙酮酸比值显著高于环孢素组。环孢素给药与平均动脉压(MAP)和脑灌注压(CPP)升高有关[31]。此外,从0到3天,环孢素组的MAP和CPP明显高于安慰剂组,尽管MAP保持在正常的生理范围内。在24和48小时,环孢素组的平均血尿素氮(BUN)水平高于安慰剂组,但它们也保持在正常范围内。在24小时内,环孢素组的平均白细胞计数高于安慰剂组。除此之外,两种治疗之间的实验室检查结果没有显著差异,不良事件(ae)的发生率在两种治疗之间大致相当。在3个月或6个月时,基于GOS评分的神经系统预后无明显治疗差异[32]。
伊朗的一项非随机、安慰剂对照临床研究检测了环孢素对GCS评分≤10且有DAI临床和影像学证据的TBI患者的作用。环孢素(5mg /kg)或对照物(5%葡萄糖水)连续输注24小时,在创伤后8?小时内开始。在3个月和6个月时评估疗效。根据迷你精神状态检查(MMSE)结果,环孢素组(n=50)和安慰剂组(n=50)的所有患者在3个月和6个月时均出现中度或重度认知障碍[33]。治疗组在3个月和6个月时MMSE结果或GOSE评分无显著差异。虽然没有详细介绍,但据报道,环孢素组和安慰剂组之间的死亡和感染数据具有可比性。环孢素组48小时BUN水平高于安慰剂组。此外,其他安全指标(肌酐、天冬氨酸转氨酶、丙氨酸转氨酶和碱性磷酸酶)的水平在正常范围内,并且在治疗组之间具有可比性。
NeuroSTAT临床开发的第一项临床研究是在健康志愿者中进行的I期开放标签实验室盲交叉研究,以确定NeuroSTAT与参考环孢素制剂Sandimmune之间的生物等效性。NeuroSTAT和Sandimmune以5mg /kg的单一剂量,以恒定速率输注超过4小时。65名受试者参加了研究,其中63人接受了至少一剂研究药物。该分析包括了完成研究的52名受试者的数据。对于AUC0-last和Cmax, NeuroSTAT/Sandimmune几何平均比值的90%置信区间均在0.80-1.25的生物等效性范围内[14]。两例SAEs(类过敏反应和过敏性反应)均发生在给予Sandimmune后。给予NeuroSTAT后未见不良反应记录。
CHIC (Copenhagen Head Injury cyclosporin)是一项开放标签的Ib/IIa期临床试验,研究了两种NeuroSTAT给药方案对严重TBI患者的药代动力学、安全性和疗效生物标志物的影响(GCS 4-8),以及室外引流和颅内压监测的临床指征。患者给予2.5 mg/kg静脉负荷剂量,随后连续5天输注5mg /kg/天(n=10)或10mg /kg/天(n=6)。脑脊液环孢素浓度-时间谱显示所有患者均可检测到环孢素浓度。停止持续输注后,血液和脑脊液中的PK谱相似,提示脑脊液的消除是通过血液中的消除来决定的。平均稳态浓度表明CSF中的剂量比例暴露。
在脑脊液样本中测量的生物标志物中检测到阳性药效学信号。胶质纤维酸性蛋白(GFAP)、NF-L、Tau和泛素羧基末端水解酶(UCH)-L1水平在5天的NeuroSTAT治疗期间呈下降趋势,在治疗结束后的随访期间呈上升趋势。图2A显示了患者脑脊液NF-L随时间变化的值。NF-L和其他研究的生物标志物的浓度变化趋势(输注后与输注期间的斜率)具有统计学意义(图2B)[28]。这些发现令人兴奋,但由于缺乏对照组和小样本量,应被认为是初步的。
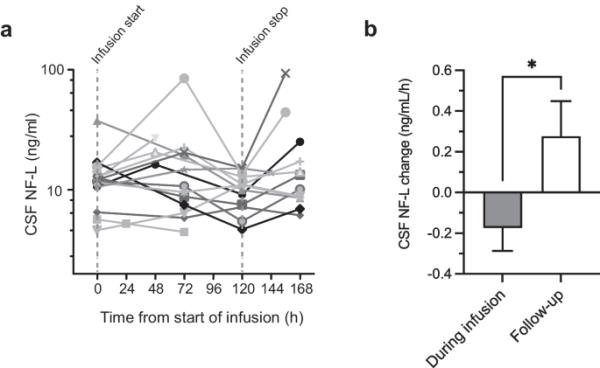
NeuroSTAT在哥本哈根头部损伤环孢素Ib/IIa期临床试验中的药效学信号。脑脊液(CSF)中脑损伤生物标志物神经丝光(NF-L)的时间谱。A在给药前、连续注射NeuroSTAT期间和治疗结束后抽取的脑脊液样本中NF-L的个体水平。虚线表示注射开始和停止。CSF,脑脊液B神经stat输注期间和停止输注后随访期间NF-L斜率的变化。数据以平均值和扫描电镜表示。* p < 0.05。经出版商许可改编自[28]
CHIC试验中报告了21例与NeuroSTAT相关的ae。其中包括5例血浆胱抑素C增高,3例血浆肌酐增高,2例少尿。血浆胆红素水平在两个剂量组治疗期间均有所升高,但较高剂量组(10 mg/kg/天)升高更为明显。此外,与5 mg/kg/天剂量组相比,10 mg/kg/天剂量组高胆红素血症发生率更高。10 mg/kg/天组中有1例患者出现急性肾小管坏死,可能是并发脓毒症的结果。颅内压升高的4个事件被评估为与研究治疗无关,颅内压不受NeuroSTAT治疗的明显影响。
如上所述,环孢素广泛的神经保护作用已在多项临床前研究中得到证实,有坚实的实验证据支持环孢素在弥漫性和局灶性挫伤模型中的有效性(表1)。此外,在具有混合基础病理的严重TBI患者的临床研究中,已经探索了安全且耐受的给药方案。基于这些令人兴奋的临床前和临床数据,环孢素作为创伤性脑损伤的潜在治疗方法值得进一步研究。
最近对创伤性脑损伤生物学、诊断和预后生物标志物以及医学影像学的了解取得了进展,这将促进神经保护化合物的进一步开发。首先,专注于单一病理性TBI内表型(即更复杂表型背后的内部可测量表型[34,35])将最大限度地减少患者异质性,并提高评估药理学结果的能力。一个有吸引力的候选者主要是DAI内表型。DAI是最常见、最严重的TBI之一,具有高度的细胞内继发性损伤级联激活[3]。一项系统综述和荟萃分析得出结论,伴有DAI的TBI患者发生不良结局的风险是不伴有DAI的TBI患者的3倍[36]。环孢素的作用机制与DAI密切相关,及时治疗原发损伤可防止继发脑萎缩。
液体生物标志物和神经影像学是诊断DAI和追踪DAI后神经退行性变的潜在敏感指标[37]。两者都被纳入了大型自然历史研究,为调查研究提供了有价值的数据来源,并为分析生物标志物轨迹与长期临床结果之间的关系提供了充分的动力[17,38]。
DAI特别感兴趣的生物标志物是NF-L,一种在长髓鞘白质轴突中发现的蛋白质。研究表明,脑外伤后血清NF-L升高,脑外伤后血清NF-L水平可预测临床预后[39,40,41]。使用NeuroSTAT的仔猪临床前研究和临床CHIC研究均表明,环孢素治疗期间NF-L水平降低[28,30]。
脑外伤后脑萎缩已被证明可预测认知和神经心理预后[42,43,44]。可以通过重复磁共振成像(MRI)扫描来测量整体和局部萎缩,比较创伤后不久的伪基线评估和随后的随访评估。MRI弥散张量成像也可以对DAI进行敏感评估,并且通过分数各向异性评估DAI的位置和范围已被证明可以预测进行性萎缩的程度[45]。诸如此类的先进成像技术应该有助于临床研究人员根据环孢素的短期反应更准确地预测创伤性脑损伤患者的长期预后。
由于它的偶然发现,环孢素的神经保护作用已被探索和验证了广泛的临床前和临床研究。环孢素的未来临床发展将得益于对脑外伤内表型的进一步了解,以及生物标志物和MRI作为临床研究工具的进一步发展。这些重要的进展将增加临床试验成功的可能性,使环孢素在更均匀的人群中进行评估,使临床疗效可以可视化和量化。现在是时候开发治疗脑损伤的神经保护剂,以解决历史上服务不足的脑损伤患者的未满足需求。
下载原文档:https://link.springer.com/content/pdf/10.1007/s13311-023-01414-z.pdf
本文来自作者[邦左]投稿,不代表文学号立场,如若转载,请注明出处:https://8ucq.com/wenxuehao/12662.html


评论列表(4条)
我是文学号的签约作者“邦左”!
希望本篇文章《环孢素治疗创伤性脑损伤》能对你有所帮助!
本站[文学号]内容主要涵盖:文学号, 名著深析, 创作秘笈, 经典文脉, 诗词鉴赏, 作家故事, 每日文萃, 写作指南, 文本细读, 文学灯塔, 经典重释
本文概览:创伤性脑损伤(TBI)的药物开发一直受到疾病病理复杂性和异质性的阻碍,以及对初始创伤后继发性损伤级联的了解有限。因此,...